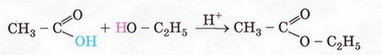Хімічні властивості оцтової кислоти
1) електролітична дисоціація: CH3COOH = CH3COO1- + H1+
ацетат - йон
Оцтова кислота – слабкий електроліт. Зміна забарвлення індикаторів в кислому середовищі оцтової кислоти:
метилоранжевий – рожевий
лакмус – червоний
2) Взаємодія з металами:
2СН3СООН + Мg = Mg(CH3COO)2 + H2 ↑ магній ацетат
3) Взаємодія з оксидами металів:
2СН3СООН + СаО = Са(СН3СОО)2 + Н2О
кальцій ацетат
4) Взаємодія з лугами:
СН3СООН + NaOH = NaCH3COO + H2O
натрій ацетат
5) Взаємодія з солями, утвореними слабшими кислотами:
2СН3СООН + Na2CO3 = 2 NaCH3COO + [H2CO3] CO2↑+ H2O
вугільна кислота
нестійка, розкладається!!!
6) Взаємодія зі спиртами:
СН3СООН + С2Н5ОН = СН3СООС2Н5 + Н2О
етилацетат
(етиловий естер оцтової кислоти)
 Віртуальний
кабінет
хімії
Віртуальний
кабінет
хімії